Assalamu'alaikum kawan kawan..
sudah lama ya saya tidak posting lagi.. ya karena saya sudah terkena virus liburan, jadi males gini deh.. sekarang saya akan membagikan seperti judul diatas, sebelum masuk ke macam macam atom s.. silahkan baca dulu Perkembangan atom di bawah.. Selamat membaca Minna, dan selamat menikmati :
Perkembangan Model Atom
Seorang filsuf Yunani yang bernama Democritus
berpendapat bahwa jika suatu benda dibelah terus menerus, maka pada
saat tertentu akan didapat akan didapat bagian yang tidak dapat dibelah
lagi. Bagian seperti ini oleh Democritus disebut atom. Istilah atom
berasal dari bahasa yunani “a” yang artinya tidak, sedangkan “tomos”
yang artinya dibagi. Jadi, atom artinya tidak dapat dibagi lagi.
Pengertian ini kemudian disempurnakan menjadi, atom adalah bagian
terkecil dari suatu unsur yang tidak dapat dibelah lagi namun namun
masih memiliki sifat kimia dan sifat fisika benda asalnya.
Atom dilambangkan dengan ZXA, dimana A = nomor massa (menunjukkan massa atom, merupakan jumlah proton dan neutron), Z = nomor atom (menunjukkan jumlah elektron atau proton). Proton bermuatan positif, neutron tidak bermuatan (netral), dan elektron bermuatan negatif. Massa proton = massa neutron = 1.800 kali massa elektron. Atom-atom yang memiliki nomor atom sama dan nomor massa berbeda disebut isotop, atom-atom yang memiliki nomor massa sama dan nomor atom berbeda dinamakan isobar, atom-atom yang memiliiki jumlah neutron yang sama dinamakan isoton.
Atom dilambangkan dengan ZXA, dimana A = nomor massa (menunjukkan massa atom, merupakan jumlah proton dan neutron), Z = nomor atom (menunjukkan jumlah elektron atau proton). Proton bermuatan positif, neutron tidak bermuatan (netral), dan elektron bermuatan negatif. Massa proton = massa neutron = 1.800 kali massa elektron. Atom-atom yang memiliki nomor atom sama dan nomor massa berbeda disebut isotop, atom-atom yang memiliki nomor massa sama dan nomor atom berbeda dinamakan isobar, atom-atom yang memiliiki jumlah neutron yang sama dinamakan isoton.
1. Model Atom John Dalton
Ini adalah Foto Atomnya Om Dalton
Pada tahun 1808, John Dalton
yang merupakan seorang guru di Inggris, melakukan perenungan tentang
atom. Hasil perenungan Dalton menyempurnakan teori atom Democritus.
Bayangan Dalton dan Democritus adalah bahwa atom berbentuk pejal. Dalam
renungannya Dalton mengemukakan postulatnya tentang atom:
- Setiap unsur terdiri dari partikel yang sangat kecil yang dinamakan dengan atom
- Atom dari unsur yang sama memiliiki sifat yang sama
- Atom dari unsur berbeda memiliki sifat yang berbeda pula
- Atom dari suatu unsur tidak dapat diubah menjadi atom unsur lain dengan reaksi kimia, atom tidak dapat dimusnahkan dan atom juga tidak dapat dihancurkan
- Atom-atom dapat bergabung membentuk gabungan atom yang disebut molekul
- Dalam senyawa, perbandingan massa masing-masing unsur adalah tetap
Teori atom Dalton mulai membangkitkan minat terhadap penelitian mengenai model atom. Namun, teori atom Dalton memiliki kekurangan, yaitu tidak dapat menerangkan suatu larutan dapat menghantarkan arus listrik. Bagaimana mungkin bola pejal dapat menghantarkan arus listrik padahal listrik adalah elektron yang bergerak. Berarti ada partikel lain yang dapat menghantarkan arus listrik.
2. Model Atom J.J. Thomson
Kelemahan dari Dalton diperbaiki oleh JJ. Thomson, eksperimen yang dilakukannya tabung sinar kotoda. Hasil eksperimennya menyatakan ada partikel bermuatan negatif dalam atom yang disebut elektron. Suatu bola pejal yang permukaannya dikelilingi elektron dan partikel lain yang bermuatan positif sehingga atom bersifat netral. Gambar atom model Thomson :
Kelemahan model Thomson ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut.
3. Model Atom Rutherford
Rutherford
melakukan penelitian tentang hamburan sinar α pada lempeng emas. Hasil
pengamatan tersebut dikembangkan dalam hipotesis model atom Rutherford.
a. Sebagian besar dari atom merupakan permukaan kosong.
b. Atom memiliki inti atom bermuatan positif yang merupakan pusat massa atom.
c. Elektron bergerak mengelilingi inti dengan kecepatan yang sangat tinggi.
d. Sebagian besar partikel α lewat tanpa mengalami pembelokkan/hambatan. Sebagian kecil dibelokkan, dan sedikit sekali yang dipantulkan.
Kelemahan Model Atom Rutherford
a. Menurut hukum fisika klasik, elektron yang bergerak mengelilingi inti memancarkan energi dalam bentuk gelombang elektromagnetik. Akibatnya, lama-kelamaan elektron itu akan kehabisan energi dan akhirnya menempel pada inti.
b. Model atom rutherford ini belum mampu menjelaskan dimana letak elektron dan cara rotasinya terhadap inti atom.
c. Elektron memancarkan energi ketika bergerak, sehingga energi atom menjadi tidak stabil.
d. Tidak dapat menjelaskan spektrum garis pada atom hidrogen (H).
a. Sebagian besar dari atom merupakan permukaan kosong.
b. Atom memiliki inti atom bermuatan positif yang merupakan pusat massa atom.
c. Elektron bergerak mengelilingi inti dengan kecepatan yang sangat tinggi.
d. Sebagian besar partikel α lewat tanpa mengalami pembelokkan/hambatan. Sebagian kecil dibelokkan, dan sedikit sekali yang dipantulkan.
Kelemahan Model Atom Rutherford
a. Menurut hukum fisika klasik, elektron yang bergerak mengelilingi inti memancarkan energi dalam bentuk gelombang elektromagnetik. Akibatnya, lama-kelamaan elektron itu akan kehabisan energi dan akhirnya menempel pada inti.
b. Model atom rutherford ini belum mampu menjelaskan dimana letak elektron dan cara rotasinya terhadap inti atom.
c. Elektron memancarkan energi ketika bergerak, sehingga energi atom menjadi tidak stabil.
d. Tidak dapat menjelaskan spektrum garis pada atom hidrogen (H).
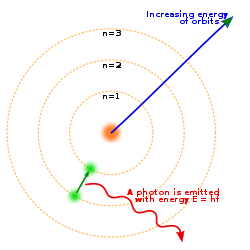
4. Model Atom Niels Bohr
Ini adalah Foto Model Atom OM Bohr
Pada tahun 1913, Niels Bohr mengemukakan pendapatnya bahwa elektron bergerak mengelilingi inti atom pada lintasan-lintasan tertentu yang disebut kulit atom. Model atom Bohr merupakan penyempurnaan dari model atom Rutherford.
Kelemahan teori atom Rutherford diperbaiki oleh Neils Bohr dengan postulat bohr :
a. Elektron-elektron yang mengelilingi inti mempunyai lintasan dan energi tertentu.
b. Dalam orbital tertentu, energi elektron adalah tetap. Elektron akan menyerap energi jika berpindah ke orbit yang lebih luar dan akan membebaskan energi jika berpindah ke orbit yang lebih dalam
Kelebihan model atom Bohr
atom terdiri dari beberapa kulit untuk tempat berpindahnya elektron.
Kelemahan model atom Bohr
a. tidak dapat menjelaskan efek Zeeman dan efek Strack.
b. Tidak dapat menerangkan kejadian-kejadian dalam ikatan kimia dengan baik, pengaruh medan magnet terhadap atom-atom, dan spektrum atom yang berelektron lebih banyak.
5. MODEL ATOM MODERN
Model atom modern didasarkan pada teori mekanika kuantum (1927), yaitu sebagai berikut:
a. Atom terdiri dari inti atom yang mengandung proton dan neutron, dan elektron yang mengitari inti atom pada oarbital-orbitalnya.
b. Dengan memadukan azas ketidakpastian Heisenberg dan mekanika gelombang dari Broglie maka Schodinger merumuskan konsep "Orbital adalah suatu ruangan dimana peluang elektron ditemukan".
c. Kedudukan elektron pada orbital-orbital dinyatakan dengan bilangan kuantum.
CIRI KHAS MODEL ATOM MEKANIKA GELOMBANG
1. Gerakan elektron memiliki sifat gelombang, sehingga lintasannya (orbitnya) tidak stasioner seperti model Bohr, tetapi mengikuti penyelesaian kuadrat fungsi gelombang yang disebut orbital (bentuk tiga dimensi darikebolehjadian paling besar ditemukannya elektron dengan keadaan tertentu dalam suatu atom)
2. Bentuk dan ukuran orbital bergantung pada harga dari ketiga bilangan kuantumnya. (Elektron yang menempati orbital dinyatakan dalam bilangan kuantum tersebut)
3.
Posisi elektron sejauh 0,529 Amstrong dari inti H menurut Bohr bukannya
sesuatu yang pasti, tetapi bolehjadi merupakan peluang terbesar
ditemukannya elektron
Terima kasih telah membaca artikel tentang Perkembangan Model Atom (Kimia) di blog Ruru Project jika anda ingin menyebar luaskan artikel ini di mohon untuk mencantumkan link sebagai Sumbernya, dan bila artikel ini bermanfaat silakan bookmark halaman ini diwebbroswer anda, dengan cara menekan Ctrl + D pada tombol keyboard anda.